|
Inhaltsübersicht | Nanomaschinen | Moleküle | Programme | Kurse | Fun | Links |
||
| > |
PDB Moleküle des Monats
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z |
|
 |
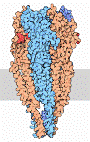
Acetylcholin (ACh) ist einer der wichtigsten Neurotransmitter in vielen Organismen, so auch im Menschen. Es vermittelt zum Beispiel die Erregungsübertragung zwischen Nerv und Muskel an der neuromuskulären Endplatte und löst so die Muskelkontraktion aus. Die Acetylcholinesterase schaltet das Signal wieder ab, indem sie Acetylcholin zu Acetat und Cholin spaltet. Die Acetylcholinesterase ist eines der schnellsten Enzyme überhaupt (diffusionskontrolliert). Die große Geschwindigkeit ist erforderlich, um den Zeitabstand zwischen den von den Neuronen übertragenen Reizen durch sofortigen Abbau des Neurotransmitters so kurz wie möglich zu halten. ... mehr darüber in Wikipedia: Acetylcholin, Acetylcholin-Esterase |
 |
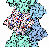
Acetylcholinrezeptoren sind membranständige Rezeptoren in verschiedenen Bereichen des Nervensystems, die als Substrat den Neurotransmitter Acetylcholin (ACh) binden. In diesem Tutorial wird der nicotinische ACh-Rezeptor der neuromuskulären Endplatte vorgetellt, der einen Ligand-gesteuerten Ionenkanal darstellt. Er übermittelt der Muskelzelle den Befehl, sich zusammenzuziehen. Ein zweiter Type, der muscarinische ACh-Rezeptor ist ein G-Protein-gekoppelter Rezeptor mit einer Struktur, die der des Lichtrezeptors Rhodopsin ähnelt.
.. mehr darüber in Wikipedia: Acetylcholinrezeptor |
| 89 Aconitase |
|
| 100 Adrenerger Rezeptor |
|
 |
Aktin ist ein Strukturprotein, das in allen eukaryotischen Zellen vorkommt. Aktin-Monomere lagern sich in der Zelle zu langen Fasern zusammen, die als wichtiger Bestandteil des Zytoskeletts die Form und Beweglichkeit der Zelle bestimmen. In Muskelfasern wird duch die Interaktion von Myosin mit Aktin die Muskelkontraktion erzeugt.
.. mehr darüber in Wikipedia: Aktin |
 |
In der alkoholischen Gärung (zB in der Hefe) bewirkt die Alkoholdehydrogenase die Umwandlung von Acetaldehyd zu Alkohol. In der menschlichen Leber katalysiert sie die umgekehrte Reaktion: Alkohol wird zu Acetaldehyd umgewandelt, das weiter zu Acetat oxydiert und so über Acetyl-Coenzym A in den Zitratzyklus eingeschleust wird. .. mehr darüber in Wikipedia: Alkoholdehydrogenase |
 |
Amylasen sind Enzyme, die sowohl im Pflanzen- als auch im Tierreich vorkommen. Ihre Wirkung besteht darin, dass sie Polysaccharide (z. B. Stärke) an den Glykosidbindungen spalten und abbauen. alpha-Amylase (EC 3.2.1.1) spaltet die α(1-4)-Glykosidbindung der Amylose. Dadurch entstehen Dextrine und daraus Maltose, Glucose und verzweigte Oligosaccharide. beta-Amylase (EC 3.2.1.2) spaltet vom Kettenende her jeweils ein Maltosemolekül nach dem anderen ab. Sie kann daher umso besser wirken, je mehr Kettenenden durch die alpha-Amylase bereits entstanden sind.
Im Menschen wird Amylase in der Bauchspeicheldrüse (Pankreas-Amylase ) und in der Speicheldrüsen der Mundhöhle (Speichel-Amylase, alpha-Amylase, Ptyalin) gebildet. Der größte Teil des Enzyms wird in den Verdauungstrakt ausgeschüttet. Mit der Nahrung aufgenommene Kohlenhydrate werden dadurch für den Körper verwertbar. .. mehr darüber in Wikipedia: Amylase |
 |
Aminoacyl-tRNA-Synthetasen sind Enzyme, die die tRNA abhängig von ihrer Sequenz (insbesondere ihrer Anticodon-Sequenz) mit ihren spezifischen Aminosäuren beladen. Damit eine tRNA mit der entsprechenden Aminosäure (AS) beladen werden kann, muss die Aminoacyl-tRNA Synthetase die AS zuerst aktivieren. Dies geschieht durch Bildung einer Säureanhydridbindung zwischen der Aminosäure und ATP, wobei AS-AMP und Pyrphosphat entstehen. Nun kann die mit AMP verbundene AS auf das 3'-Ende der tRNA übertragen werden, wobei das AMP-Molekül wieder abgespalten wird. Durch ihre Aminosäuren- und tRNA-Spezifität definieren die Aminoacyl-tRNA-Synthetasen den genetischen Code
.. mehr darüber in Wikipedia: Aminoacyl-tRNA Synthetase |
| Im Gehirn von Patienten, die an Alzheimer, einer schweren neurodegenerativen Erkrankung, leiden, findet man Ablagerungen eines Peptids beta-Amyloid-Peptid), das durch proteolytische Spaltung aus dem Transmembranprotein Amyloid-beta Precursor Protein (APP) gebildet wird. Abhängig von der relativen Aktivität zweier Proteasen, der beta- und der gamma-Sekretase wird beim Abbau des APP oder unschädliche lösliche Fragmente gebildet
.. mehr darüber in Wikipedia: Alzheimer |
|
 |
Anthrax-Toxin
.. mehr darüber in Wikipedia: Anthrax |
 |
Antikörper
.. mehr darüber in Wikipedia: Antikörper |
 |
Die ATP Synthase ist Turbine und Generator in den Kraftwerken, die die Energieversorgung der Zelle sicherstellen. Protonen, die durch den in die Organellenmembran eingebetteten Teil der ATP-Synthase entlang ihres Konzentrationsgradienten von einem Kompartiment mit tieferem pH in eines mit höherem pH fliessen, lösen eine Drehbewegung aus. Die mechanische Energie dieser Drehbewegung liefert die Energie, um eine Bindung zwischen der terminalen Phosphatgruppe in ADP und einem weiteren Phosphat zu knüpfen und so den zellulären Energieträger ATP zu regenerieren. Unter Laborbedingungen kann man die ATP-Synthase auch als Protonenpumpe verwenden, die unter ATP-Verbrauch einen Protonengradienten aufbaut.
... mehr darüber in Wikipedia: ATP-Synthase |
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z |
|
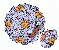 |
Bacteriophage phiX174. Bakteriophagen ("Bakterienfresser") sind Viren, die sich auf Bakterien spezialisiert haben. Eine Hülle aus Protein umgibt und schützt einen DNS-Strang. Kommt das Virus mit einem geeigneten Bakterium in Kontakt, bindet es an die Oberfläche und injiziert seine DNS in das Bakterium, das dadurch gezwungen wird, die virale DNS zu kopieren und virale Proteinen zu synthetisieren, die sich zu neuen Viren zusammenlagern. .. mehr darüber in Wikipedia: Bakteriophage |
 |
Bakteriorhodopsin
.. mehr darüber in Wikipedia: Bakteriorhodopsin, Rhodopsin |
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z |
|
| 99 Cadherine |
|
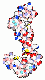 |
Calmodulin
.. mehr darüber in Wikipedia: Calmodulin |
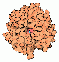 |
Carbonic Anhydrase
.. mehr darüber in Wikipedia: Carboanhydrase |
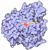 |
Carotenoid Oxygenase |
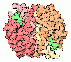 |
Caspasen sind eine Familie von Proteasen mit einem Cystein im aktiven Zentrum. Sie spalten Peptidbindungen C-Terminal von Aspartat. Daher der Name: C-Asp-ase (Englisch cysteinyl-aspartate-cleaving proteases). Caspasen sind die wichtigsten Enzyme der Apoptose, dem programmierten Zelltod. Die 3D-Struktur von Caspasen wird an unserem Institut in der Arbeitsgruppe von Prof. Markus Grütter untersucht.
.. mehr darüber in Wikipedia: Caspase |
 |
Catabolite Activator Protein |
 |
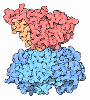
Chaperone: Neu synthetisierte Proteine müssen zunächst ihre spezifische, native Konformation finden. Diese ist zwar grundsätzlich in der Primärstruktur angelegt, und kleinere Proteine können sich auch spontan in der richtigen Weise falten (das klassische Beispiel für spontane Faltung ist die Ribonuklease). Vor allem bei größeren, komplexeren Proteinen sind aber oft weitere Hilfsmittel zur korrekten Faltung nötig. Ansonsten neigen solche Proteine zur Bildung von unerwünschten Aggregationen. Chaperone (französisch Anstandsdamen) sind Proteine, die neu synthetisierten Proteinen "helfen", sich korrekt zu falten. Die Bezeichnung wurde gewählt, da sie "unreife Proteine vor schädlichen Kontakten bewahren".
.. mehr darüber in Wikipedia: Chaperon (Protein) |
 |
Das Cholera-Toxin ist ein von Bakterien der Arten Vibrio cholerae und Vibrio eltor produziertes Gift, das beim Menschen eine schwere Durchfallerkrankung auslösen kann. Das Cholera-Toxin dringt in die Zellen ein und katalysiert die Übertragung der ADP-Ribose von NAD+ auf die alpha-Untereinheit von stimulierendem G-Protein; was die GTPase Aktivität blockiert und es so zu einer kontinuierlichen Aktivierung der Adenylatcyclase von Zellen des Darmepithels und einer chronisch hohen cAMP - Konzentration kommt. Dies bewirkt eine ständige Abgabe von Chloridionen, HCO3- und Wasser über den Darm.
.. mehr darüber in Wikipedia: Choleratoxin |
| 97 Circadian Clock |
|
| 93 Citrate Synthase |
|
| Clathrin | |
 |
Collagen ist ein bei Menschen und Tieren vorkommendes Strukturprotein der extrazellulären Matrix. Kollagen ist mit über 30 % Anteil am Gesamtgewicht aller Eiweiße (Proteine) das verbreitetste Eiweiß im menschlichen Körper. Es ist der organische Bestandteil von Knochen und Zähnen und der wesentliche Bestandteil von Sehnen, Bändern und Haut. Kollagenfasern besitzen eine enorme Zugfestigkeit und sind nicht dehnbar. Seinen Namen erhielt das Collagen (aus dem Griechischen: Leim erzeugend) ursprünglich aufgrund seiner früheren Nutzung als Knochenleim im Holzhandwerk.
.. mehr darüber in Wikipedia: Collagen |
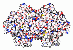 |
Die Cyclooxygenase ist ein intrazelluläres Enzym der Prostaglandinsynthese und spielt somit eine entscheidende Rolle bei der Entzündungsreaktion. Es katalysiert die Umwandlung von Arachidonsäure zu Prostaglandin. Dabei wird ein Ringschluss zwischen den Kohlenstoffatomen C8 und C12 erreicht sowie zwei Sauerstoffatome an C9 und C11 eingefügt, die anschließend eine kovalente Bindung miteinander eingehen, so dass eine Epoxidstruktur entsteht. Das Produkt sind Prostaglandin G2 und H2. Pharmazeutisch wichtige Inhibitoren der Cyclooxygenasen sind die nichtsteroidalen Antirheumatika wie zum Beispiel Acetylsalicylsäure (Aspirin), Diclofenac und Ibuprofen, sowie die sogenannten selektiven COX-2-Hemmer.
.. mehr darüber in Wikipedia: Cyclooxygenase |
 |
Cytochrome c ist ein Protein aus der Familie der Cytochrome, das in den Kraftwerken der Zelle, den Mitochondrien, bei der Energiegewinnung eine entscheidende Rolle spielt und aus etwa 100 Aminosäuren besteht. Zwei Moleküle Cytochrom c werden von der Atmungskette an der inneren Mitochondrienmembran von einem Coenzym Q (CoQ) reduziert. Die Cytochrom c Oxidase katalysiert daraufhin die Reoxidation von Cytochrom c und den Elektronenübertrag auf terminale Elektronenakzeptoren (z. B. Sauerstoff). Bei Beschädigung der Mitochondrien wird Cytochrom c ins Cytosol abgegeben, wo es über eine Signalkaskade den programmierten Zelltod (Apoptose) auslöst. .. mehr darüber in Wikipedia: Cytochrom C |
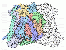 |
Das Enzym Cytochrome c Oxidase (EC 1.0.3.1) ist der terminale Elektronenakzeptor in der mitochondrialen Atmungskette (Komplex IV).
.. mehr darüber in Wikipedia: Cytochrom C Oxydase |
| Cytochrom p450 | |
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z |
|
| Dengue-Virus | |
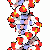 |
DNA
.. mehr darüber in Wikipedia: Desoxyribonukleinsäure |
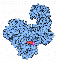 |
DNA Ligase sind Enzyme, die DNA-Stränge verknüpfen. Sie bilden dabei eine Esterbindung zwischen einem Phosphatrest und dem Zucker Desoxyribose aus.
Bei der DNA-Replikation entstehen auf dem diskontinuierlichen Strang nicht zusammenhängende DNA-Stücke, die Okazaki-Fragmente. Die Verknüpfung dieser Stücke wird ebenfalls von Ligasen bewerkstelligt. .. mehr darüber in Wikipedia: DNA-Ligase |
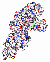 |
DNA Polymerase
Eine DNA-Polymerase ( oder auch: DNA-abhängige DNA-Polymerase) ist ein Enzym, welches die Synthese von DNA aus Desoxyribonukleotiden an einer DNA-Matrize katalysiert. DNA-Polymerasen spielen eine Schlüsselrolle bei der DNA-Replikation. .. mehr darüber in Wikipedia: DNA-Polymerase |
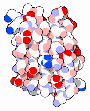 |
Designerproteine |
 |
Dihydrofolatreduktase
.. mehr darüber in Wikipedia: Folat, Methotrexat |
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z |
|
| Elongationsfaktoren | |
 |
Exosomen bauen nicht mehr benötigte Messenger-RNS ab |
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z |
|
 |
Ferritin (lat. ferrum, Eisen) ist ein Transport- bzw. Speicherprotein des menschlichen Körpers, das in der Lage ist, eine große Zahl von Eisenionen zu binden. Die Ferritinkonzentration im menschlichen Blutserum ist ein sehr aussagekräftiges Maß für den gesamten Eisenspeicher des Organismus. Die Bestimmung des Ferritin-Spiegels ist heutzutage Routine in den meisten Kliniklabors und hat vor allem bei der Anämie-Diagnostik einen hohen Stellenwert, wenn der Verdacht auf eine Eisenmangelanämie vorliegt. .. mehr darüber in Wikipedia: Ferritin, Transferrin |
| 90 Fettsäure-Synthase |
|
| Fibrin | |
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z |
|
| G Proteine sind molekulare Schalter. Bindung von GTP und die Spaltung von gebundenem GTP bewirken eine Konformationsänderungen, die die Assoziation mit andern Proteinen steuern. Heterotrimere G-Protein übermitteln Signale von
.. mehr darüber in Wikipedia: G-Protein |
|
 |
Glucose Oxidase
Das Enzym Glukose-Oxidase oxidiert Glucose mit hilfe von Sauerstoff zur Gluconsäure. Das dabei entstehende Wasserstoffperoxid kann zum quantitativen Nachweis von Glukose zB. in Serum oder Urin mit einer Farbreaktion nachgewiesen werden. Dieser Nachweis ist spezifisch für die Glucose. .. mehr darüber in Wikipedia: Glukose-Oxidase |
 |
Glutamine Synthetase |
 |
Glycogen Phosphorylase |
 |
Glycolytische Enzyme
Glykolyse (aus dem Griechischen glykys = süß und lysis = auflösen) ist der erste Teil des Glukose-Katabolismus in den Zellen aller Lebewesen. In diesem biochemischen Abbauweg wird ein Molekül Glukose in zehn enzymatisch katalysierten Reaktionen in zwei Pyruvat-Moleküle umgewandelt. .. mehr darüber in Wikipedia: Glykolyse |
 |
Das Grün-fluoreszierende Protein (GFP) bzw. green fluorescent protein ist ein erstmals 1962 von Osamu Shimomura beschriebenes Protein der Qualle Aequorea victoria, das bei Anregung mit blauen oder ultravioletten Licht grün fluoresziert. Seine kaum zu überschätzende Bedeutung in der Biologie, insbesondere der Zellbiologie, liegt in der Möglichkeit, GFP mit beliebigen anderen Proteinen Gen-spezifisch zu fusionieren. Durch die Fluoreszenz des GFP kann so die räumliche und zeitliche Verteilung des anderen Proteins in lebenden Zellen, Geweben oder Organismen direkt beobachtet werden
.. mehr darüber in Wikipedia: Green Fluorescent Protein |
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z |
|
 |
Hemagglutinin
Das Glycoprotein Hämagglutinin (HA) ist eines der drei intergralen Membranproteine des Influenzavirus A. Die beiden anderen integralen Membranproteine des Influenzavirus A ist der protonenleitende Kanal M2 und das Enzym Neuraminidase (NA). Das HA ist mit den meisten Kopien (Anzahl) in der Virusmembran vertreten (M2: Anzahl, NA: Anzahl). .. mehr darüber in Wikipedia: Hämagglutinin |
 |
Hemoglobin Als Hämoglobin (Hb) bezeichnet man den eisenhaltigen roten Blutfarbstoff in den roten Blutkörperchen (Erythrozyten) der Wirbeltiere, der dem Sauerstofftransport dient.
.. mehr darüber in Wikipedia: Hämoglobin |
 |
HIV-1 Protease
.. mehr darüber in Wikipedia: Protease-Inhibitor |
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z |
|
 |
Insulin
.. mehr darüber in Wikipedia: Insulin |
 |
Importine
.. mehr darüber in Wikipedia: Kernlokalisierungssignal |
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z |
|
 |
Der Kaliumkanal (engl. potassium channel) ist ein in die Zellmembran integrierter Proteinkomplex, der in spezifischer Weise den Durchtritt für Kaliumionen durch eine Membran gestattet. Der Transport von Kaliumionen durch den Kaliumkanal erfolgt passiv durch Diffusion. Seine Richtung wird durch die elektrochemische Triebkraft für Kaliumionen bestimmt.
.. mehr darüber in Wikipedia: Kaliumkanal |
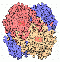 |
Das Enzym Katalase beseitigt das starke Zellgift Wasserstoffperoxid (H2O2) durch Disproportionierung zu Sauerstoff (O2) und Wasser (H2O).
.. mehr darüber in Wikipedia: Katalase |
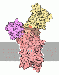 |
Kalziumpumpe
.. mehr darüber in Wikipedia: Natrium-Kalzium-Austauscher |
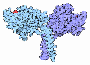 |
Kinesin
Kinesin bezeichnet eine Gruppe von Motorproteinen in eukaryotischen Zellen. In Kooperation mit anderen Motorproteinen, wie Myosin und Dynein sind sie wesentlich am intrazellulären Transport von biologischen Lasten wie z. B. Biomakromolekülen, Vesikeln und Zellorganellen beteiligt. Kinesin kommt zusammen mit Dynein an Mikrotubuli-Filamenten (Bestandteil des Cytoskeletts) als Transporter von Vesikeln und anderen Molekülen vor. .. mehr darüber in Wikipedia: Kinesin |
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z |
|
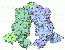 |
Lac Repressor
.. mehr darüber in Wikipedia: Repressor |
| Luciferasen sind strukturell unterschiedliche Enzyme, unter deren Anwesenheit Luciferine mit Sauerstoff reagieren (Oxidation) und es zur Biolumineszenz kommt. Unterschieden werden unter anderen Firefly-Luciferasen (aus dem Leuchtkäfer), bei denen Luciferol, ATP und Sauerstoff zu Kohlendioxid, AMP und Licht reagieren und Renilla-Luziferasen die nur Luziferol und Sauerstoff (kein ATP) zur Reaktion benötigen. Luziferasen sind art- oder gruppenspezifisch, also für jede Tiergruppe kennzeichnend. Dabei sind die Luziferasen im Laufe der Evolution aus anderen Enzymen, den Oxygenasen, hervor gegangen. .. mehr darüber in Wikipedia: Luziferasen |
|
| Lactat-Dehydrogenase | |
 |
Lysozym (auch: Muramidase) ist ein in Speichel, Tränen, Ohrenschmalz sowie Nasen- und Darmschleimhäuten, aber auch im Blutplasma vorkommendes Enzym (EC 3.2.1.17), das gegen Bakterien wirkt, indem es deren Zellwand abbaut. Es ist wichtig für die Abwehr bakterieller Infektionen.
.. mehr darüber in Wikipedia: Lysozym |
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z |
|
 |
Major Histocompatibility Complex (Abk. MHC von engl.: Major Histocompatibility Complex) umfasst eine Gruppe von Genen bei Wirbeltieren, die Informationen zur Herstellung von Proteinen, die für die Immunerkennung, die Gewebeverträglichkeit (Histokompatibilität) bei Transplantationen und die immunologische Individualität wichtig sind. MHC-Regionen finden sich in allen Wirbeltieren ab den Knorpelfischen (Haie, Rochen).
.. mehr darüber in Wikipedia: Haupthistokompatibilitätskomplex, Human Leukocyte Antigen |
| 95 Multi-Drug Resistance |
|
 |
Myoglobin, Molekulargewicht 17.053 Dalton, ist ein Häm-haltiges Protein, das eine hohe Affinität zu Sauerstoff hat. Mit Myoglobin nahe verwandt ist das erst vor kurzem entdeckte Cytoglobin, welches in nahezu allen Zellen der Wirbeltiere vorkommt. Es dient vermutlich ebenso als Sauerstoffspeicher in der Zelle. Es scheint, dass Myoglobin wohl während der Evolution durch eine Genduplikation die muskelspezifische Variante des Cytoglobins geworden ist.
.. mehr darüber in Wikipedia: Myoglobin, Cytoglobin |
 |
Myosin bezeichnet eine Familie von Motorproteinen in eukaryotischen Zellen. Als wesentlicher Bestandteil im Muskel ist es auch an der Umwandlung von chemischer Energie in Kraft und Bewegung beteiligt. Im Gegensatz zu Kinesin und Dynein, die sich entlang von Mikrotubuli bewegen, bewegt sich Myosin entlang von Aktinfilamenten. Weitere zellulären Funktionen umfassen unter anderem Zellbewegung und -adhäsion.
.. mehr darüber in Wikipedia: Myosin |
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z |
|
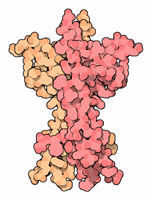 |
Neurotrophine Neurotrophine sind körpereigene Signalstoffe, die zielgerichtete Verbindungen zwischen Nervenzellen bewirken. Sie sind kleine basische Proteine mit einem Molekulargewicht von etwa 13 kDa. Es gibt fünf Typen von Neurotrophinen: NGF - Nervenwachstumsfaktor, BDNF - brain-derived neurotrophic factor, NT-3 - Neurotrophin 3, NT-4 - Neurotrophin 4, NT-5 - Neurotrophin 5. Da NT-4 und NT-5 ähnliche Eigenschaften besitzen, werden sie häufig als NT-4/5 zusammengefasst.
Neurotrophine können an membranständige Rezeptoren binden. Es existieren zwei Typen von Rezeptoren für Neurotrophine: p75 Neurotrophin Rezeptor (p75NTR), ein Rezeptor der TNF-Rezeptor Familie Rezeptoren der Tyrosinkinase-Rezeptor-Familie (Trk A, Trk B und Trk C) Die Bindung von Neurotrophinen an p75NTR führt zum programmierten Zelltod (siehe Apoptose) der Zelle. Bindung an Rezeptoren der Trk-Familie hingegen löst eine Kaskade von Kinasen aus, die sich anti-apoptotisch auswirkt. Zentrales Enzym dieses Mechanismus ist die, vor allem im angloamerikanischen Sprachraum, auch als „AKT“ bekannte Proteinkinase B. Aufgrund dieses ambivalenten Verhaltens sieht man Neurotrophine heute nicht mehr als Neurostimulatoren an, sondern als Neuromodulatoren. .. mehr darüber in Wikipedia: Neurotrophin |
 |
Nitrogenase
.. mehr darüber in Wikipedia: Nitrogenase |
 |
Nucleosom Die erste Verpackungsstufe der DNA höherer Zellen ist ein Komplex aus DNA und Histonen, das so genannte Nukleosom.
.. mehr darüber in Wikipedia: Nukleosom |
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z |
|
 |
Oestrogenrezeptor |
| 96 Oxydosqualene Synthase |
|
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z |
|
 |
p53 Tumor Suppressor
.. mehr darüber in Wikipedia: Tumorsuppressorprotein p53 |
 |
Penicillin-bindende Proteine
.. mehr darüber in Wikipedia: Penizillin, Antibiotikaresistenz |
 |
Pepsin Pepsin ist ein Verdauungsenzym, eine so genannte Peptidase, die in den Mägen von Wirbeltieren für den Abbau von mit der Nahrung aufgenommenen Eiweißen zuständig ist.
.. mehr darüber in Wikipedia: Pepsin |
 |
Phenylalanine Hydroxylase |
 |
Photosystem I
.. mehr darüber in Wikipedia: Photosystem |
 |
Photosystem II
.. mehr darüber in Wikipedia: Photosystem |
 |
Poliovirus and Rhinovirus
.. mehr darüber in Wikipedia: Poliovirus |
| 101 Prionen | |
| Proteasom/Ubiquitin | |
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z |
|
 |
Restriktionsenzyme sind molekulare Scheren, die DNS sequenzspezifisch zerschneiden. Bakterien benützen Restriktionsenzyme, um sich gegen fremde DNS (zB. Bacteriophagen) zu schützen. Ihre eigene DNS schützen sie, indem sie die Erkennungsstellen durch Methylierung maskieren. Restriktionsenzyme sind eines der wichtigsten Werkzeuge der modernen Gentechnologie.
.. mehr darüber in Wikipedia: Restriktionsenzym |
 |
Reverse Transkriptasen ( auch RNA-abhängige DNA-Polymerasen) sind Enzyme, die die Umschreibung von RNA in DNA katalysieren. Früher galt das Dogma, das DNA nur in RNA übersetzt wird, nicht umgekehrt. Heute weiss man, dass Retroviren eine Reverse Transkriptase besitzen, die RNA in DNA übersetzt, und auch die Telomerase in Eukaryotischen Organismen enthält eine reverse Transkriptase. Die reverse Transkriptase des HIV-Virus ist einer der Angriffspunkte für moderne AIDS-Medikamente. .. mehr darüber in Wikipedia: Reverse Transkriptase |
| Ribonuklease A | |
 |
Ribosomen sind Komplexe aus Proteinen und Ribonukleinsäuren (RNA), die im Cytoplasma der Zellen von Lebewesen vorkommen. An ihnen werden Proteine hergestellt, und zwar entsprechend der Basensequenz der DNA, die die Information zur Aminosäuresequenz der Proteine enthält. Eine RNA-Kopie des Gens dient als Steuerelement, das den Einbau der richtigen Aminosäure in der richtigen Reihenfolge sicherstellt. Dabei besteht das katalytisch aktive Zentrum der Ribosoms nicht aus Protein, sondern aus RNA. .. mehr darüber in Wikipedia: Ribosom |
 |
Als RNA Polymerase bezeichnet man Enzyme, die die Synthese von Ribonukleinsäure-Molekülen (RNA) an der DNA oder an der RNA durch Transkription katalysieren. Bei Prokaryonten gibt es nur eine Form der RNA-Polymerase, bei Eukaryoten unterscheidet man drei Formen: die RNA-Polymerase I, die die Bildung von rRNA als prä-rRNA (45S wird prozessiert zu 18S; 5.8S; 28S) und manche snRNAs (small nuclear RNA) im Nucleolus katalysiert, die RNA-Polymerase II, die die Bildung der meisten mRNA katalysiert, und die RNA-Polymerase III, die die Bildung von tRNA, 7SL-RNA und 5S rRNA katalysiert. Diese RNA-Polymerasen sind DNA-abhängig. .. mehr darüber in Wikipedia: RNA-Polymerase |
 |
Rubisco (Ribulose-1,5-bisphosphat-carboxylase/-oxygenase) ist das mengenmäßig häufigste Protein der Erde, da es alle photosynthetisch aktiven Pflanzen und Bakterien zur Dunkelreaktion der Photosynthese benötigen. Es leitet die Kohlenstoffdioxid-Fixierung im Calvin-Zyklus ein.
.. mehr darüber in Wikipedia: Rubisco |
 |
Ribonukleinsäuren sind nicht nur inerte Informationsträger, sie können auch selbst enzymatische Aktivität aufweisen (Ribozyme). Selbst-splicende RNAs sind in der Lage, RNA-Fragmente aus einer längeren RNA sequenzspezifisch herauszuschneiden und die Enden wieder zu verknüpfen. Auf diese Weise werden Intron-Sequenzen aus eukaryonischen Boten-RNAs entfernt.
.. mehr darüber in Wikipedia: Ribonukleinsäure |
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z |
|
| Selenocystein Synthase |
|
 |
Serpine (SERinProteaseINhibitor)
.. mehr darüber in Wikipedia: Antithrombin |
 |
Serumalbumin Serumalbumin ist das .. mehr darüber in Wikipedia: Albumin |
 |
Simian Virus 40 |
| 98 siRNA |
|
 |
Src Tyrosinekinase |
| 92 Steroid-Rezeptoren |
|
 |
94 Superoxide Dismutase |
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z |
|
 |
TATA-Binding Protein
.. mehr darüber in Wikipedia: TATA-Box |
 |
T-Cell Receptor
.. mehr darüber in Wikipedia: T-Zell-Rezeptor |
 |
Thrombin Die Serin-Protease Thrombin spielt eine wichtige Rolle bei der Blutgerinnung. Sie wird durch eine Kaskade von Gerinnungsfaktoren aktiviert und spaltet Fibrinogen zu Fibrin, das sich zum Blutgerinnsel zusammenlagert .. mehr darüber in Wikipedia: Thrombin |
 |
91 Tymine Dimers |
 |
Tissue Factor .. mehr darüber in Wikipedia: Blutgerinnung, |
 |
Topoisomerasen
.. mehr darüber in Wikipedia: Topoisomerase |
 |
Transfer RNA
.. mehr darüber in Wikipedia: transfer-RNA |
|
|
Transposase : Transposons (springende Gene) sind mobile genetische Elemente, die sich aus ihrer Position auf dem Chromosom herauslösen und sich an andere Stelle wieder ins Genom integrieren können.
.. mehr darüber in Wikipedia: Transposon |
 |
Trypsin
.. mehr darüber in Wikipedia: Trypsin |
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z |
|
 |
Ubiquitin ist ein aus 76 Aminosäuren bestehendes Polypeptid mit einem Molekulargewicht von etwa 8,5 kDa. Die Sequenz ist hochgradig konserviert, unterliegt also kaum der Mutation. Die Sequenz des Ubiquitins der Hefe unterscheidet sich zum Beispiel von der des Menschen in nur drei Aminosäuren. Die native Konformation ist globulär, lediglich die letzten vier C-terminalen Aminosäuren ragen hervor. In der Zelle werden zum Abbau bestimmte Protein durch ATP-abhängige Ubiquitinylierung markiert. Derart markierte Proteine werden in einem proteolytischen Komplex (Proteasom) abgebaut.
.. mehr darüber in Wikipedia: Ubiquitin |
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z |
|
 |
Wachstumshormon
.. mehr darüber in Wikipedia: Somatotropin |
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z |
|
| Zinkfinger |