|
Inhaltsübersicht | Nanomaschinen | Moleküle | Programme | Kurse | Fun | Links |
||
| > |
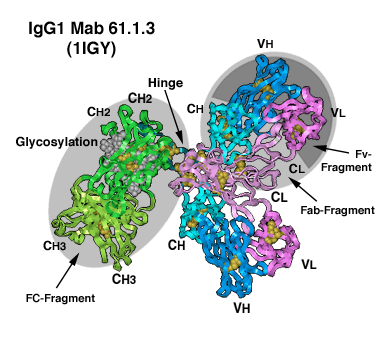
Struktur eines Antikörpers (IgG1)
- Klicken Sie auf eine der Domänen, um diese in einer interaktiven 3D-Darstellung zu sehen, oder wählen Sie ein Konstrukt aus der Liste.
Der Vergleich der IgG2a-Struktur (PDB entry 1IGT) und der IgG1-Struktur (PDB entry 1IGY) zeigt die Flexibilität der Hing-Region:in beiden Strukturen ist das FC-Fragment gleich ausgerichtet, aber die beiden Fab-Arme zeigen in unterschiedlicher Richtungen. Diese Flexibilität erschwert die Kristallisation von intakten Antikörpern. Daher enthalten die meisten Strukturen von Antikörper-Antigen-Komplexen in der PDB Datenbank Strukturen nur Fab- oder Fv- Fragmente des Antikörpers. Durch Verdauung von monoklonalen Antikörpern mit der Protease Papain wird die Hinge-Region zerstört, und die Fab-Fragmente können aufgereinigt werden. Durch Verdauung mit Pepsin erhält man (Fab)2-Fragmente, in denen ein Teil der Hinge erhalten ist und die zwei Fab-Fragmente noch über Disulfidbrücken zusammenhängen.
Einzelne Domänen, Fv-Fragmente und Fab Fragments können heutzutage auch als rekombinante Proteine in E. coli produziert werden. In diesem Fall wird häufig das Single-chain Fv Format eingesetzt: Eine VL und eine VH Domäne , die durch einen flexiblen Peptid-Linker von 15-20 Aminosäuren Länge verbunden sind. Kürzere Linker führen zur Dimerisierung (Diabodies), da der Linker zu kurz ist, um die korrekte Paarung der beiden Domänen über eine intramolekulare interaktion zu erlauben.