|
Inhaltsübersicht | Nanomaschinen | Moleküle | Programme | Kurse | Fun | Links |
||
| > |
Grün-Fluoreszierendes Protein
Das Grün fluoreszierende Protein (Abkürzung GFP; engl. green fluorescent protein) ist ein erstmals 1962 von Osamu Shimomura beschriebenes Protein der Qualle Aequorea victoria, das bei Anregung mit blauen oder ultravioletten Licht grün fluoresziert. Seine kaum zu überschätzende Bedeutung in der Biologie, insbesondere der Zellbiologie, liegt in der Möglichkeit, GFP mit beliebigen anderen Proteinen Gen-spezifisch zu fusionieren. Durch die Fluoreszenz des GFP kann so die räumliche und zeitliche Verteilung des anderen Proteins in lebenden Zellen, Geweben oder Organismen direkt beobachtet werden
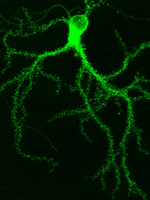

GFP besteht aus 238 Aminosäuren und hat ein Molekulargewicht von 26.9 kDa. Der eigentliche Fluorophor des GFP bildet sich offenbar autokatalytisch aus der Tripeptidsequenz Ser65-Tyr66-Gly67 innerhalb der 238 Aminosäuren umfassenden Polypeptidkette. Diese intrinsische Fluoreszenz basiert nicht auf einem Umbau durch ein externes Enzym oder nachträglich integrierte Substanzen, kommt also vollständig ohne eventuell zellspezifische Prozessierungssysteme aus.
In seiner Ursprungsorganismus erhält GFP seine Anregungsenergie durch strahlungsfreien Energietransfer vom Photoproteins Aequorin. In Anwendungen wird GFP immer optisch angeregt. Das unmodifizierte, natürlich vorkommende GFP hat zwei Anregungsmaxima. Das erste liegt bei einer Wellenlänge von 395 nm, das zweite bei 475 nm. Die Emissionswellenlänge liegt bei 509 nm.
Wikipedia: Grün fluoreszierendes Protein
PDB Molecule of the Month # 42 Green Fluorescent Protein
Das Genprodukt, aus dem das Grün-Fluoreszierende Protein entsteht, ist ohne spezielle Kofaktoren. Die Peptidkette bildet ein gekrümmtes beta-Faltblatt das sich zu einer schliesst, einem sogenannten (beta-Fass). Ein Strang der Peptidkette läuft durch die Mitte dieses Fasses.
Nachdem sich die Kette gefaltet hat, geschieht spontan eine chemische Umwandlung von drei Aminosäuren in diesem Teil der Kette: Katalysiert durch die Proteinumgebung wird aus diesen drei Aminosäuren der gebildet.